Neue Veröffentlichung in "Communications Chemistry"
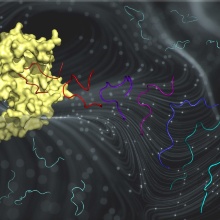
Die SETD2-Protein Lysinmethyltransferase spielt eine sehr wichtige Rolle bei der Chromatinregulation in menschlichen Zellen und hat starke Verbindungen zu Krebs. In früheren Arbeiten haben wir ein Supersubstrat des SETD2 entdeckt, das etwa 100-mal schneller methyliert wird als das ursprüngliche H3K36-Substrat. Der Mechanismus hinter dieser faszinierenden Steigerung der Enzymaktivität wurde jedoch nicht aufgedeckt. Hier haben wir die Wechselwirkung von SETD2 und den beiden unterschiedlichen Substratpeptiden mithilfe von Molekular Dynamik Simulationen und biochemischen Experimenten untersucht und die Beobachtung gemacht, dass das Supersubstrat in mehreren Schritten Vorteile hat. In Lösung zeigen wir durch MD und biochemische Daten, dass es eine Haarnadelkonformation bevorzugt. Nachfolgende sMD- und biochemische Studien zeigten dann, dass diese Haarnadel-Konformation effizienter an SETD2 bindet. Im SETD2-Peptid-Komplex werden zusätzliche Kontakte gebildet und es wurden unterschiedliche Übergangszustandsstrukturen für beide Peptide identifiziert, die weiter zu der erhöhten Methylierungsrate beitragen. Insgesamt wurden neue Prinzipien der Substratinteraktion der Proteinmethyltransferase entdeckt, die zahlreiche Folgestudien ermöglichen werden.