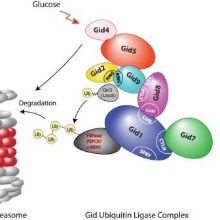
Die korrekte Regulation der großen Kohlenhydratstoffwechselwege Glykolyse und Gluconeogenese ist essentiell für Organismen. Beim Menschen führt ihre Fehlregulation zu der Stoffwechselkrankheit Diabetes. In dem eukaryonten Modellorganismus Hefe ist die Katabolitdegradation der regulatorischen gluconeogenetischen Enzyme Fructose-1,6-bisphosphatase, Phosphoenolpyruvat Carboxykinase und cytoplasmatischen Malatdehydrogenase durch das Ubiquitin-Proteasom-System bei Verfügbarkeit von Glucose ein zentraler Regulationsmechanismus. Die vorliegende Publikation beschreibt erstmalig die Topologie der Gid Ubiquitin Ligase, eines aus sieben verschiedenen Untereinheiten bestehenden RING Ligase Komplexes, der die Polyubiquitinierung der gluconeogenetischen Enzyme zum proteasomalen Abbau einleitet. Außergewöhnliche Proteindomänen bestimmen die Interaktion der Untereinheiten des Gid Komplexes.