Neue Veröffentlichung in "Nucl. Acids Res."
Trotz ihrer zentralen
Bedeutung für die Säugetierentwicklung sind die Mechanismen zur Regulation der
DNA-Methylierungsmaschinerie und damit die Erzeugung von genomischen Methylierungsmustern noch
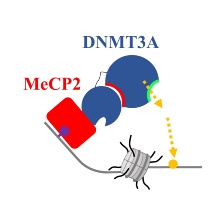
wenig verstanden. Hier identifizieren wir das 5mC-bindende Protein MeCP2 als einen direkten und
starken Interaktor von DNMT3-Proteinen. Wir kartierten die Interaktionsschnittstelle mit der
TRD-Domäne von MeCP2 und der ADD-Domäne von DNMT3A und zeigen, dass die Bindung von MeCP2 die
Aktivität von DNMT3A in vitro stark inhibiert. Dieser Effekt wurde durch zelluläre Studien
bestätigt, in denen eine globale Reduktion der DNA-Methylierung nach Überexpression von MeCP2 in
menschlichen Zellen beobachtet wurde. Die Interaktion mit MeCP2 und die daraus resultierende
Hemmung wurde durch die Bindung von K4 unmodifiziertem Histon H3 an die DNMT3A ADD Domäne
aufgehoben, was darauf hindeutet, dass die Lokalisation und Aktivität von DNMT3A unter der
Kontrolle von MeCP2 und H3 Modifikationen stehen. Abhängig vom H3 Modifikationsstatus
an Bindungsstellen kann MeCP2 entweder als Repressor oder Aktivator der DNA-Methylierung
wirken.